
Białka, czyli główny budulec wszystkiego.
Witamy w trzecim artykule skierowanym do uczniów/studentów. W firmie Gentaur jest to dla nas ważne by oprócz sprzedaży produktów diagnostycznych również edukować innych. W artykułach będą się pojawiać głównie zagadnienia biochemiczne. Możliwe, że również później pojawią się teksty związane z innymi przedmiotami. Razem odkryjemy, że biochemia nie jest aż taka straszna jak się wydaje.
Białka - informacje ogólne:

Białka przedstawiają ogromne zróżnicowanie funkcji, ale wszystkie mają wspólną cechę strukturalną. Wszystkie są liniowymi polikondensatami aminokwasów. Prawie wszystkie grupy aminowe i karboksylowe aminokwasów w białkach są połączone ze sobą za pomocą wiązania peptydowego. Białka ssaków są zbudowane z 20 różnych aminokwasów.
Aminokwasy:
Każdy z aminokwasów posiada grupę karboksylową, pierwszorzędową grupę aminową i łąńcuch boczny przy atomie węgla alfa. W pH około 7,4 grupa karboksylowa jest zdysocjowana i tworzy ujemnie naładowany jon karboksylowy a grupa aminowa ulega protonowaniu. Charakter łańcuchów bocznych ostatecznie decyduje o roli, jaką aminokwas pełni w białku. Aminokwasy mogą posiadać niepolarne łańcuchy boczne, czyli łańcuch ten nie zyskuje ani nie tracie protonów. Nie tworzy również wiązań wodorowych lub jonowych. Łańcuchy te traktowane są jako lipofilowe. Aminokwasy mogą również posiadać polarne łańcuchy boczne. Oznacza to, że posiadają one zerowy ładunek netto w obojętnym pH. Łańcuchy boczne cysteiny i tyrozyny mogą tracić proton w zasadowym pH. Łańcuchy boczne seryny, treoniny i tyrozyny posiadają polarną grupę hydroksylową, która bierze udział w tworzeniu wiązań wodorowych. Za to łańcuchy boczne asparaginy i glutaminy posiadają grupę karbonylową i amidową i obie mogą tworzyć wiązania wodorowe. Aminokwasy mogą również posiadać kwasowe i zasadowe łańcuchy boczne.
Aminokwasy z niepolarnymi łańcuchami bocznymi

Aminokwasy z polarnymi łańcuchami bocznymi
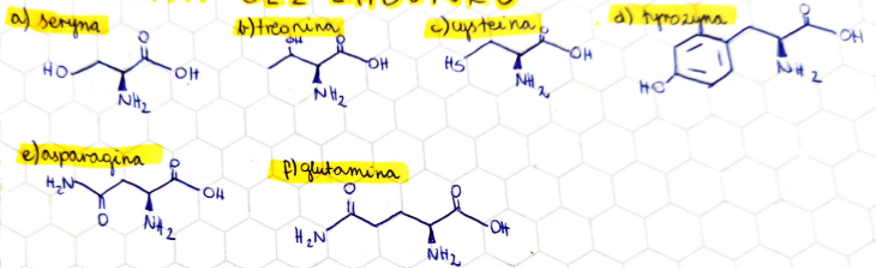
Aminokwasy z kwasowymi łańcuchami bocznymi
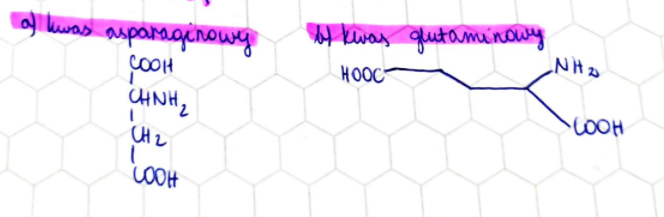
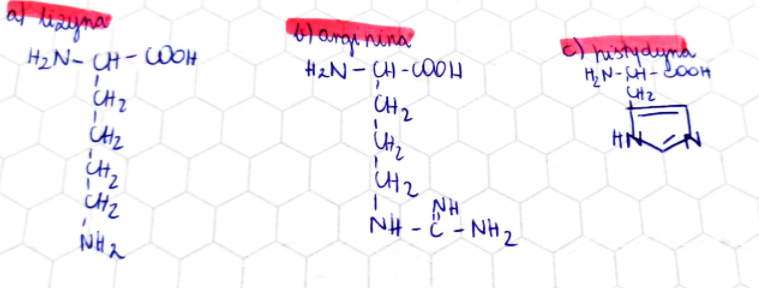
Aminokwasy z zasadowymi łańcuchami bocznymi
Struktury białek:
- pierwszorzędowa
- drugorzędowa
- trzeciorzędowa
- czwartorzędowa
Struktura pierwszorzędowa
Jest to sekwencja aminokwasów w białku. Wiązanie wiodące w tej strukturze to wiązanie peptydowe. Powstaje ono między grupą alfa-karboksylową jednego aminokwasu i grupę alfa-aminową drugiego. Wiązania te są odporne na czynniki denaturujące białko. Wiązanie peptydowe mają charakter częściowego wiązania peptydowego. Jest ono sztywne, planarne i polarne.
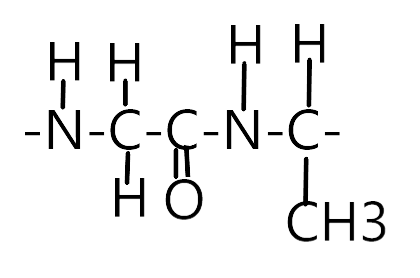
Struktura drugorzędowa
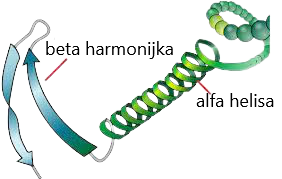
Struktura ta to sposób zwinięcia wiązań peptydowych. Może ona występować w postaci alfa helisy bądź beta harmonijki. Alfa helisa to sztywna, prawoskrętna struktura spiralna, która składa się ze szczelnie upakowanego, spiralnego rdzenia polipeptydowego, z łańcuchami bocznymi składowych L-aminokwasów wysuniętymi na zewnątrz w stosunku do osi centralnej, w celu uniknięcia wzajemnych oddziaływań sterycznych. Alfa helisa występuje na przykład w keratynie. Jest ona stabilizowana przez wielokrotnie rozmieszczone wiązania wodoroweg występujące pomiędzy atomami tlenu grupy karbonylowej wiązania peptydowego i atomami wodoru ugrupowania amidowego, które są częścią szkieletu polipeptydowego. W strukturze beta wszystkie składniki wiązania peptydowego są zaangażowane w tworzenie wiązania wodorowego Fałdowanie tej struktury wynika z występowania kolejnych węgli nieznacznie powyżej lub poniżej płaszczyzny kartki. Struktura ta powstaje z dwóch lub większej liczby łańcuchów peptydowych, ułożonych obok siebie i stabilizowanych wiązaniami wodorowymi wytwarzanymi między wiązaniami peptydowymi aminokwasów położonych daleko od siebie w tym samym łańcuchu polipeptydowym (wiązania wewnątrzłańcuchowe) lub obecnych w różnych łańcuchach polipeptydowych (wiązania międzyłańcuchowe).
Struktura trzeciorzędowa
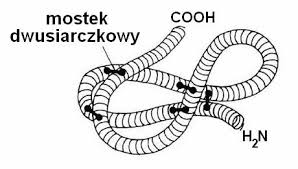
Struktura ta odnosi się zarówno do fałdowania się domen jak i do ostatecznego ułożenia ich w łańcuchu polipeptydowym. Domeny to podstawowe funkcjonalne i przestrzenne jednostki strukturalne polipeptydów. Każda domena ma cechy małego, zwartego białka globularnego, które jest strukturalnie niezależne od innych domen w łańcuchu polipeptydowym. Struktura ta to również wzajemne ułożenie segmentów o strukturze drugorzędowej. W roztworze wodnym jest zwarta, o dużej gęstości atomów w rdzeniu cząsteczki. Jej hydrofobowe łańcuchy boczne są schowane we wnętrzu, podczas gdy grupy hydrofilowe występują powszechnie na powierzchni cząsteczki. Stabilizują ją wiązania wodorowe, jonowe i disiarczkowe.
Struktura czwartorzędowa
Struktura to ułożenie polipeptydów w białkach oligomerycznych. Podjednostki są utrzymywane razem przede wszystkim dzięki interakcjom niekowalencyjnym. Podjednostki mogą działać niezależnie od siebie albo wspólnie, tak jak w cząsteczce hemoglobiny, w przypadku której związanie tlenu z jedną podjednostką tetrameru zwiększa powinowactwo tlenu do pozostałych podjednostek.

Fałdowanie białek:

Podział białek:
- białka proste – złożone tylko z aminokwasów
- białka złożone – zawierające dodatkowe grupy np. lipoproteiny, glikoproteiny
Funkcje biologiczne białek:
- enzymatyczna – nukleaza
- regulacyjna – insulina
- transportowa – hemoglobina
- zapasowa – ferrytyna
- ruch – miozyna
- strukturalna – kolagen
- ochronna – immunoglobuliny
